Lluvia acida
CONTAMINACION AMBIENTAL
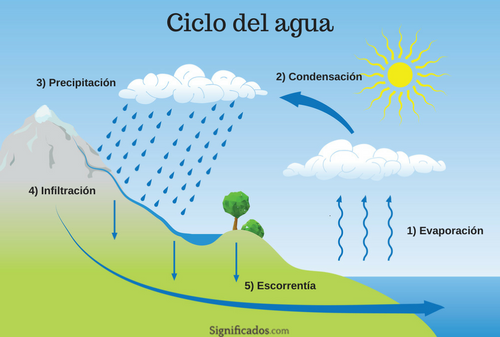
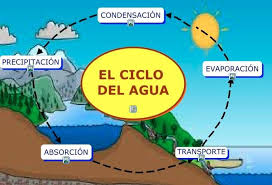
Se llama lluvia ácida a la que se forma cuando la humedad del aire se combina con óxidos de nitrógeno, dióxido de azufre o trióxido de azufre emitidos por fábricas, centrales eléctricas, calderas de calefacción y vehículos que queman carbón o productos derivados del petróleo que contengan azufre. En interacción con el agua de la lluvia, estos gases forman ácido nítrico, ácido sulfuroso y ácido sulfúrico.1 Finalmente, estas sustancias químicas caen a la tierra acompañando a las precipitaciones, constituyendo la lluvia ácida.
Los contaminantes atmosféricos primarios que dan origen a la lluvia ácida pueden recorrer grandes distancias, siendo trasladados por el viento a cientos o miles de kilómetros antes de precipitar en forma de rocío, lluvia, llovizna, granizo, nieve, niebla o neblina. Cuando la precipitación se produce, puede provocar deterioro en el medio ambiente.
La lluvia normalmente presenta un pH de aproximadamente 5,65 (ligeramente ácido), debido a la presencia del CO2 atmosférico, que forma ácido carbónico, H2CO3. Se considera lluvia ácida si presenta un pH menor que 51 y puede alcanzar el pH del vinagre (pH 3), valores que se alcanzan cuando en el aire hay uno o más de los gases citados.
FORMACION DE UNA LLUVIA ACIDA
Una gran parte del SO2 (dióxido de azufre) emitido a la atmósfera procede de la emisión natural que se produce por las erupciones volcánicas, que son fenómenos irregulares. Sin embargo, una de las fuentes de SO2 es la industria metalúrgica.
El SO2 puede proceder también de otras fuentes, por ejemplo como el sulfuro de dimetilo, (CH3)2S, y otros derivados, o como sulfuro de hidrógeno, H2S. Estos compuestos se oxidan con el dioxígeno atmosférico dando SO2. Finalmente el SO2 se oxida a SO3 (interviniendo en la reacción radicales hidroxilo y oxígeno) y este SO3 puede quedar disuelto en las gotas de lluvia. Las emisiones de SO2 se generan en procesos de obtención de energía: el carbón, el petróleo y otros combustibles fósiles contienen azufre en unas cantidades variables (generalmente más del 1 %), y, debido a la combustión, el azufre se oxida a dióxido de azufre.
S + O2 → SO2
Los procesos industriales en los que se genera SO2, por ejemplo, son los de la industria metalúrgica. En la fase gaseosa el dióxido de azufre se oxida por reacción con el radical hidroxilo por una reacción intermolecular.
SO2 + OH· → HOSO2
seguida por
HOSO2· + O2 → H2O· + SO 3
En presencia del agua atmosférica o sobre superficies húmedas, el trióxido de azufre (SO3) se convierte rápidamente en ácido sulfúrico (H2SO4).
SO3(g) + H2O(l) → H2SO4(l)
Otra fuente de dióxido de azufre son las calderas de calefacción domésticas que usan combustibles que contiene azufre (ciertos tipos de carbón o gasóleo).
El NO se forma por reacción entre el dioxígeno y el dinitrógeno atmosféricos a alta temperatura.
O2 + N2 → 2 NO
Una de las fuentes más importantes es a partir de las reacciones producidas en los motores térmicos de los automóviles y aviones, donde se alcanzan temperaturas muy altas. Este NO se oxida con el dioxígeno atmosférico,
O2 + 2NO → 2 NO2
y este NO2 reacciona con el agua dando ácido nítrico (HNO3), que se disuelve en el agua.
3 NO2 + H2O → 2 HNO3 + NOPara evitar esta producción se usan en los automóviles con motor de gasolina los catalizadores, que disocian el óxido de nitrógeno antes de emitirlo a la atmósfera. Los vehículos con motor diésel no pueden llevar catalizadores y por lo tanto, en este momento son los únicos que producen este gas.
EFECTOS DE UNA LLUVIA ACIDA
La acidificación de las aguas de lagos, ríos y mares dificulta el desarrollo de vida acuática, lo que aumenta en gran medida la mortalidad de peces. Igualmente, afecta directamente a la vegetación, por lo que produce daños importantes en las zonas forestales, y acaba con los microorganismos fijadores de nitrógeno.2Una gárgola que ha sido dañada por la lluvia ácida.El término "lluvia ácida" abarca la sedimentación tanto húmeda como seca de contaminantes ácidos que pueden producir el deterioro de la superficie de los materiales. Estos contaminantes que escapan a la atmósfera al quemar carbón y otros componentes fósiles reaccionan con el agua y los oxidantes de la atmósfera y se transforman químicamente en ácidos sulfúrico y nítrico. Los compuestos ácidos se precipitan, entonces, caen a la tierra en forma de lluvia, nieve o niebla, o pueden unirse a partículas secas y caer en forma de sedimentación seca.La lluvia ácida, por su carácter corrosivo, corroe las construcciones y las infraestructuras. Puede disolver, por ejemplo, el carbonato de calcio, CaCO3, y afectar de esta forma a los monumentos y edificaciones construidas con mármol o caliza.Un efecto indirecto muy importante es que los protones, H+, procedentes de la lluvia ácida, arrastran ciertos iones del suelo. Por ejemplo, cationes de hierro, calcio, aluminio, plomo o zinc. Como consecuencia, se produce un empobrecimiento en ciertos nutrientes esenciales y el denominado estrés en las plantas, que las hace más vulnerables a las plagas.Los nitratos y sulfatos, sumados a los cationes lixiviados de los suelos, contribuyen a la eutrofización de ríos, lagos, embalses y regiones costeras, lo que deteriora sus condiciones ambientales naturales y afectanegativamente a su aprovechamiento.Un estudio realizado en 2005 por Vincent Gauci3 de Open University, sugiere que cantidades relativamente pequeñas de sulfato presentes en la lluvia ácida tienen una fuerte influencia en la reducción de gas metano producido por metanógenos en áreas pantanosas, lo cual podría tener un impacto, aunque sea leve, en el efecto invernadero.
SOLUCIONES
Entre las medidas que se pueden tomar para reducir las emisiones de los agentes contaminantes de este problema , contamos con las siguientes:
Reducir el nivel máximo de azufre en los diferentes combustibles.
Trabajar en conjunto con las fuentes fijas de la industria para establecer disminuciones en la emisión de óxidos de azufre (SOx) y de nitrógeno (NOx), usando tecnologías para el control de emisión de estos óxidos.5
Impulsar el uso de gas natural en diversas industrias.
Introducir el convertidor catalítico de tres vías.
Conversión a gas en vehículos de empresas mercantiles y del gobierno.
Ampliación del sistema de transporte eléctrico.
Instalación de equipos de control en distintos establecimientos.
Adición de un compuesto alcalino en lagos y/o ríos para neutralizar el pH.
Control de las condiciones de combustión (temperatura, oxígeno, etc.)
.
Temas relacionados:
También te puede interesar
Esta web se reserva el derecho de suprimir, por cualquier razón y sin previo aviso, cualquier contenido generado en los espacios de participación en caso de que los mensajes incluyan insultos, mensajes racistas, sexistas... Tampoco se permitirán los ataques personales ni los comentarios que insistan en boicotear la labor informativa de la web, ni todos aquellos mensajes no relacionados con la noticia que se esté comentando. De no respetarse estas mínimas normas de participación este medio se verá obligado a prescindir de este foro, lamentándolo sinceramente por todos cuantos intervienen y hacen en todo momento un uso absolutamente cívico y respetuoso de la libertad de expresión.
No hay opiniones. Sé el primero en escribir.