AVANCES RECIENTES EN EL ESTUDIO DEL CICLO CELULAR EN PLANTAS
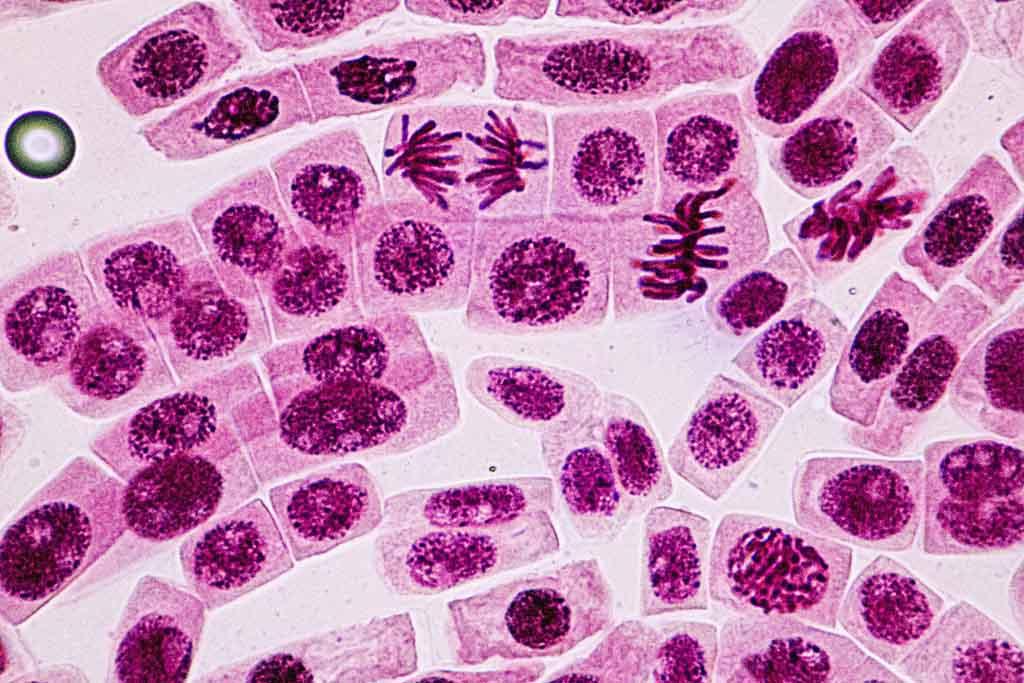
El ciclo celular, cuyo fin es la generación de células genéticamente idénticas, comprende 4 fases: G1, S, G2 y M. Durante este proceso se presentan tres puntos principales de control que se llevan a cabo en las transiciones G1/S, G2/M y en la mitosis (metafase/anafase). En estos puntos cruciales participan un conjunto de proteínas que controlan la progresión correcta del ciclo celular. Entre ellas, se encuentran varios tipos de reguladores, por ejemplo en plantas las ciclinas tipo D (CYCD) que son las que perciben las condiciones externas e internas de la célula y son muy sensibles a fitohormonas y nutrientes. También existen las cinasas dependientes de ciclinas (CDKs) y sus respetivos inhibidores como, las proteínas KRPs. Otro tipo de proteínas son los factores transcripcionales E2F, la familia de las RBRs y la proteína PCNA, entre otras.

CDKs Y CICLINAS
El avance del ciclo celular es orquestado por la actividad de los complejos CYC/CDKs, los cuales pueden ser regulados a diferentes niveles como: la expresión de sus genes, síntesis y degradación proteica, modificaciones post-traduccionales, localización de los complejos, así como la interacción con otras proteínas.
Las CDKs son proteínas cinasas de serina y treonina que en plantas, se clasifican en 8 grupos de acuerdo al motivo de unión a la ciclina: de CDKA a CDKG y CDKL. El papel de las CDKs tipo A y B es el más estudiado en el ciclo celular de las especies vegetales. El grupo de CDKAs se caracteriza por presentar un motivo canónico de unión a ciclina, altamente conservado de 7 aminoácidos; este motivo se conoce como PSTAIRE, y estructuralmente, es homólogo a las proteínas cinasas cdk/p34cdc2 de mamíferos y levaduras, respectivamente (2). En estudios del ciclo celular de distintas especies vegetales, los niveles de CDKAs tanto de transcrito y proteína son constantes en todas las fases del ciclo celular, sugiriendo una función dual de la proteína: tanto en la progresión de la fase S como en el paso a la mitosis, lo que indica que las CDKAs tienen un papel preponderante en la proliferación celular durante el desarrollo de la planta .
Las CDKs tipo B son el segundo grupo de CDKs con más representantes en el reino vegetal, carecen de homólogos en levaduras y mamíferos, y poseen un motivo de unión a ciclinas divergente, PPTALRE para CDKB1 o PPTTLRE para CDKB2. Durante el ciclo celular de distintas especies vegetales, los transcritos de CDKB muestran un pico de expresión en G2/M. Estas proteínas cinasas son capaces de unirse a las ciclinas tipo A o B (2). No obstante, también se ha documentado la interacción de ciclinas tipo D con CDKB. Por ejemplo, en Arabidopsis thaliana, la CDKB interacciona con la Ciclina D4;1 y en Nicotiana tabacum, la CDKB1;1 interacciona con Ciclina D3;1.
En general, el estado de fosforilación de las CDKs es fundamental para la funcionalidad del complejo. Su activación está determinada por la fosforilación de un residuo de treonina conservado en la zona central de la proteína (canónicamente treonina 160), mientras que la inhibición se da por la fosforilación de un residuo de treonina o de un residuo de tirosina en la región amino terminal (canónicamente la treonina 14 y la tirosina 15).
La reciente secuenciación de genomas de algunas especies vegetales, como los de Arabidopsis, arroz y maíz, entre otros, ha facilitado el estudio de los genes involucrados en el ciclo celular. Se ha encontrado un mayor número de genes relacionados a este proceso en especies vegetales que en levaduras y mamíferos , lo que sugiere una mayor complejidad en la regulación del ciclo celular. Así, en plantas se han identificado más de 100 genes de ciclinas diferentes. Por ejemplo, en Arabidopsis se encontraron 50 posibles ciclinas de diferentes tipos, que se pueden agrupar en 12 clases, de las cuales 6 no cuentan con representantes homólogos en otros eucariontes. En general, se han identificado en plantas cinco clases de ciclinas de acuerdo con su similitud con las de mamíferos: A, B, C, H y L, y siete clases exclusivas de plantas: CYL, SDS, D, Q, T, P y F. Las más estudiadas en relación al ciclo celular son las tipo A, B y D.
Si se elimina la expresión de una sola ciclina no ocasiona cambios en el fenotipo. Es necesaria la disminución en la expresión de varias ciclinas del mismo tipo para que un cambio sea evidente, lo que apoya que algunas puedan presentar funciones redundantes.
Las ciclinas son proteínas típicamente inestables, con un alto número de recambio y vida media corta, ya que algunas poseen una caja de destrucción, y un motivo denominado PEST, que las marca para ser degradadas por el proteasoma 26S (complejo multiproteico nuclear y citoplásmico cuya función es la degradación específica de proteínas marcadas) y por lo tanto les confiere inestabilidad.
El avance del ciclo celular continuo e irreversible, está regido por la síntesis y destrucción regulada de las ciclinas . Dado que las ciclinas son las unidades reguladoras de las CDKs, son las que determinan la especificidad por el blanco del complejo, fluctuando a lo largo del ciclo celular.
Las ciclinas tipo A y B comparten un alto porcentaje de identidad, incluyendo una secuencia central característica, llamada caja de ciclina, requerida para la unión con CDKs y una secuencia denominada caja de destrucción, similar a la reportada en mamíferos . Se ha propuesto que la función de estas proteínas es predominante durante las fases S y G2/M. Su degradación durante la mitosis en mamíferos es esencial para un final exitoso del ciclo celular .
Las ciclinas tipo A pueden interaccionar con CDKA y CDKB, actuando en la fase S y en la transición G2/M; las ciclinas tipo B controlan la progresión del ciclo celular durante la mitosis, y se asocian con CDKBs.
Las ciclinas tipo D de plantas, así como las de mamíferos y levaduras son fundamentales en el inicio o re-inicio del ciclo celular por su respuesta a señales externas tales como fitohormonas, tipo y concentración de azúcares, y a señales internas como puede ser la velocidad de crecimiento o el tamaño de la célula . Estructuralmente las ciclinas D contienen una región conservada de 250 aminoácidos denominada caja de ciclina que consiste de dos dominios: el N-terminal que comprende una región de unos 100 residuos de aminoácidos conservados (caja de ciclina), y el C-terminal, menos conservado y a veces ausente en algunas ciclinas. Además, casi todas presentan el motivo conservado LxCxE (donde x representa cualquier residuo de aminoácido) cercano al extremo amino terminal. Este motivo es importante para la interacción de las ciclinas con la proteína RBR (en plantas).
En plantas, las ciclinas tipo D median el primer punto de control del ciclo celular en la transición G1/S al regular la fosforilación de la proteína RBR en complejos con CDKAs. Sin embargo, poco se sabe de los complejos CYCD/CDK y su función en el ciclo celular .
INTERACTOMAS
Para el estudio de las interacciones proteicas que se presentan en distintos momentos del ciclo celular, se han empleado principalmente tres estrategias: sistemas de doble híbrido, complementación bimolecular de la fluorescencia y purificación por afinidad en tándem.
La información generada con estas metodologías ha permitido que en las últimas dos décadas se haya dilucidado la composición de los complejos CYC/CDKs, así como algunos aspectos de su regulación. Evidencias experimentales indican que estos complejos son parte clave en el control del ciclo celular, al menos en Arabidopsis, especie vegetal en la que más se ha estudiado este proceso. Entre los mecanismos de control predomina la asociación con inhibidores de CDKs, cinasas de CDKs y fosfatasas, la proteólisis dependiente de proteasoma 26S y el tráfico intracelular.
Por ejemplo, se demostró la interacción de CDKA con ciclinas tipo D durante la transición G1/S, y la interacción de CDKA con ciclinas tipo A3 en la progresión de la fase S. Así mismo, ha sido posible establecer interacciones del complejo CYCD/CDKA con inhibidores de CDK (KRPs), y la interacción de este complejo con diferentes miembros de la ruta E2F/DP/RBR. También se ha descrito que las ciclinas tipo B y tipo A2 de Arabidopsis presentan un pico de expresión en la transición G2/M (4,6) y forman complejos con CDKBs, regulando así la entrada a la fase M y la progresión de ésta.
PROTEÍNAS DE CICLO CELULAR EN MAÍZ
Se sabe que los eventos relacionados al ciclo celular en Arabidopsis marcan la pauta para extrapolar y comprender cómo se lleva a cabo el control del ciclo celular en otras plantas, sin embargo, también se han realizado ensayos en arroz, tabaco y otras especies que indican que cada especie vegetal puede tener sus particularidades. El estudio del ciclo celular, en el caso particular del maíz, se facilitó considerablemente desde el año 2009, cuando se reportó la secuencia del genoma completo de esta especie. El análisis bioinformático en busca de genes homólogos relacionados filogenéticamente con ciclinas de Arabidopsis y arroz, en el genoma de maíz, arrojó al menos once posibles genes que codifican para ciclinas tipo A, diez para ciclinas tipo B y al menos diecisiete que codifican para ciclinas tipo D . El estudio de la expresión de estos últimos durante la germinación de maíz y en tejidos de plántula (raíz, hoja y mesocotilo) mostró que 15 de ellos se expresan diferencialmente. En la zona meristemática de la raíz (grupo de células toti-potenciales y en división activa), las ciclinas D presentan niveles altos de expresión, con excepción de CYCD3;1a, lo que sugiere que esta ciclina podría presentar funciones específicas diferentes a las de otras ciclinas y, probablemente, estaría participando en procesos de desarrollo como diferenciación o endorreduplicación (tipo de ciclo celular alterno que evita el paso por mitosis y por lo tanto la célula aumenta su ploidía) (7). En maíz, también se han identificado tres genes que codifican para proteínas CDKA y tres para CDKB. La proteína CDKA presenta un patrón constante durante las primeras 24 horas de germinación, lo que indica su participación en diferentes puntos del control del ciclo celular.
OTRAS PROTEÍNAS REGULADORAS EN EL CICLO CELULAR
PCNA
El antígeno nuclear de proliferación celular (PCNA) es una proteína que inicialmente se identificó en sueros de pacientes con lupus eritematoso, una enfermedad autoinmune; después fue descrita como una proteína esencial durante la replicación del ADN. Actualmente, se sabe que la replicación no es su única función en el ciclo celular, ya que juega un papel importante en otros procesos del metabolismo del ADN, como en reparación y remodelación de la cromatina. El análisis de PCNAs de diferentes especies (mamíferos, insectos y plantas) mostró que es una proteína altamente conservada a nivel de secuencia, estructura y función (8), que interacciona con proteínas clave del ciclo celular como son las ciclinas D y CDKs.
En maíz, durante las primeras horas de germinación, PCNA se acumula, presentando una abundancia proteica basal en semilla seca y una acumulación entre las 18 y 20 horas, lo que coincide con el tiempo en que tiene lugar la replicación de ADN en células meristemáticas (9), lo cual sugiere que estas células se encuentran principalmente en fase S.
RBR
La proteína retinoblastoma o RB (pRB) fue descubierta por la identificación de mutaciones en diferentes posiciones de ambos alelos de un gen en tumores de retina, esto dio nombre a su producto. Posteriormente, la proteína fue descrita como una proteína supresora de tumores al regular los procesos de proliferación. En plantas la vía E2F/ RB se encuentra conservada, y el homólogo de pRB es conocido como proteína relacionada a RB (RBR). Esta proteína reprime la actividad de los factores de transcripción E2F/DP durante G1 y es fosforilada por los complejos CYC/CDKs para permitir el avance hacia fase S. Además de participar en el ciclo celular de plantas, así como en el de mamíferos, también tiene una función reguladora en los procesos de diferenciación y desarrollo (10).
De acuerdo con estudios filogenéticos, funcionales y de expresión de genes, la familia de genes RBR de cereales es más compleja que la de otras plantas. En gramíneas existen al menos dos clases de genes RBR: RBR1 y RBR3. En el genoma de maíz se han identificado otros dos parálogos (genes producto de duplicaciones genómicas en la misma especie) de RBR1 y RBR3, más parecidos a RBR2 y RBR4, respectivamente. El estudio de los dos tipos de proteínas RBR de maíz muestra que éstas se acumulan en distintas etapas de desarrollo. Por ejemplo, la proteína RBR3 participa en proliferación celular y la proteína RBR1 en procesos de diferenciación y endorreduplicación (11). Lo anterior podría sugerir que existe división de funciones, donde RBR3 participa en el control del ciclo celular y RBR1 en el control del desarrollo.
INHIBIDORES DE COMPLEJOS CYC/CDKs
Las proteínas relacionadas a KIP/CIP o KRPs, son inhibidores de la actividad de los complejos CYC/CDKs en plantas, pero también participan en el importe nuclear de otras proteínas del ciclo celular. Esta familia de proteínas ha sido aislada en especies de plantas tanto monocotiledóneas como dicotiledóneas. La sobreexpresión de miembros de KRP en Arabidopsis muestra fenotipos característicos de represión del ciclo celular como la reducción del tamaño de las plantas, disminución del número de células y células alargadas, indicando que las KRPs inhiben el ciclo celular, probablemente, tanto a nivel de las transiciones G1/S como de las G2/M (12).
En Arabidopsis se han descrito 7 genes que codifican para KRPs y en estudios del interactoma se reportó que estas proteínas co-purifican específicamente con ciclinas tipo D y CDKA1;1, sugiriendo que sólo inhiben a este tipo de complejos. En maíz, se observó que inhiben también la actividad de cinasa de complejos de CDKA con ciclinas tipo A y D. Otra familia de inhibidores menos caracterizados, específicos de plantas, son las proteínas SIAMESE (SIM) y las relacionadas a SIAMESE (SMR), que se han identificado en arroz, maíz, tomate y Arabidopsis, entre otras. Recientemente en el interactoma de Arabidopsis se observó que se unen a complejos de CDKA y CDKB; sugiriendo que pueden inhibir la actividad de ambas cinasas.
FAMILIA E2F/DP
Las proteínas E2F y sus socios de dimerización, las proteínas DP conforman heterodímeros que funcionan como factores transcripcionales. Los primeros estudios de la familia E2F/DP se enfocaron en entender su influencia sobre la expresión de múltiples genes requeridos para la entrada y progresión de la fase S del ciclo celular. Entre estos genes se encontraron los involucrados con la maquinaria de replicación y del metabolismo de ADN. También están involucrados en la regulación de la expresión de genes que participan en procesos biológicos como mitosis, respuesta al daño y reparación del ADN, diferenciación, desarrollo y muerte celular programada. La actividad transcripcional de E2F se modula a través de distintos mecanismos en células de mamíferos, el más conocido es a través de la interacción con pRB y otros miembros de su familia, como son p107 y p130. Al unirse pRB al heterodímero E2F/DP se reduce por impedimento estérico la interacción con proteínas co-activadoras de sus genes blanco. Tanto en animales como en plantas, la familia de E2F/DP está compuesta por tres grupos de proteínas: E2F, DEL (del inglés DP/ E2F-Like protein) y DP, clasificadas por el tipo y número de dominios de unión a ADN. Las proteínas E2F y DP necesitan heterodimerizar entre ellas para unirse con alta afinidad al ADN, mientras que los miembros del grupo DEL se unen como monómero.
Las proteínas de la familia E2F/DP pueden presentar propiedades tanto de activación transcripcional como de represión. Así, en Arabidopsis la sobreexpresión simultánea de los activadores E2Fa y DPa en tejidos diferenciados con índices mitóticos muy bajos o nulos, promueve la reentrada al ciclo celular, y la consecuente proliferación celular mediante la activación de genes de fase S. Por otro lado, la sobreexpresión del represor E2Fc reduce la tasa de división celular y aumenta la endorreduplicación. Finalmente, se ha sugerido que los miembros tipo DEL funcionan como represores por competencia, ya que son capaces de reconocer la misma secuencia en el ADN que el heterodímero E2F/DP, pudiendo así, competir por ocupar los mismos promotores (12).
MECANISMOS DE REGULACIÓN DEL CICLO CELULAR DE PLANTAS
Los mecanismos moleculares que regulan el ciclo celular en especies vegetales no se han caracterizado completamente, además de que cada especie presenta características específicas, sin embargo, con los conocimientos adquiridos se pueden inferir algunos de estos.
El ciclo celular comienza cuando las señales extracelulares activan la transcripción de genes de ciclinas D durante la fase G1 temprana y al acumularse la proteína se forman complejos CYCD/ CDK; estos complejos proteicos son regulados negativamente por las proteínas inhibidoras KRPs. Una vez que son liberados de esta represión, se activan por fosforilación de la treonina 160 de la CDK. Dicha fosforilación es catalizada por cinasas activadoras de CDKs (CAK), como CDKDo CDKF .
En la fase G1 tardía, el complejo activo CYCD/CDK fosforila a la proteína RBR, que reprime la actividad de la familia de factores transcripcionales E2F/DP. Una vez fosforilada RBR en múltiples sitios, pierde afinidad y se disocia del complejo E2F-DP permitiendo la transcripción de sus genes blanco, necesarios para el establecimiento y progresión de la fase S, como son los genes de establecimiento de origen (ORCs, MCMs, CDT1), de la maquinaria de replicación (PCNA, DNApol, entre otros) y de la progresión del ciclo celular (Ciclina A) (1, 2 y 12).
Durante la transición G2/M se lleva a cabo la transcripción de los genes de CYCA y CYCB dependiente de E2F, en respuesta a una señalización provocada por hormonas. Los complejos CYCA/B con CDKA/B son regulados negativamente por proteínas inhibidoras del tipo SIAMESE (SIM) o KRPs y por fosforilaciones inhibidoras en la CDK (catalizadas por la cinasa WEE). Una vez reparados los posibles errores ocurridos durante la replicación, las fosforilaciones inhibitorias T14/ Y15 son removidas por una fosfatasa putativa aún desconocida en plantas, pero ya identificada y estudiada en otros organismos. Similar a lo que ya se describió anteriormente, los complejos CYC/Cdk se activan por la fosforilación en T160 de CDK (catalizada por la CAK, CDKD/CDKF) permitiéndole así, la fosforilación de sus proteínas blanco para entrar a la fase M. Durante la mitosis, en la metafase, las proteínas CDC20 y CCS52 activan y dan especificidad al complejo promotor de anafase (APC), dirigiendo la degradación de ciclinas por la vía del proteasoma 26S y la consecuente salida de mitosis.
REGULACIÓN POR FITOHORMONAS Y AZÚCARES
Entre las fitohormonas u hormonas vegetales que participan en la regulación de la expresión de genes del ciclo celular y su progresión se encuentran las auxinas y las citocininas. Otras fitohormonas también tienen alguna influencia en el ciclo celular, sin embargo, han sido menos caracterizadas. Tal es el caso del ácido abscísico (ABA), el etileno, el ácido jasmónico y los brasinoesteroides. Se ha sugerido que estas últimas fitohormonas juegan un papel en la adaptación de la actividad meristemática a las condiciones externas y al programa morfogenético vegetal.
Las auxinas juegan un papel importante en casi cualquier aspecto del desarrollo vegetal. Estas fitohormonas promueven la actividad del ciclo celular y, al mismo tiempo que aumentan la expresión de genes involucrados en la transición G1/S y G2/M, estimulan la degradación de proteínas inhibidoras (15). Un ejemplo de ello, es la sobreexpresión de la CYCA2;2 de alfalfa, en presencia de auxinas. La función de esta ciclina está involucrada en ciclos mitóticos meristemáticos durante el desarrollo post-embrionario.
Similar a las auxinas, las citocininas también juegan un papel esencial en el crecimiento de las plantas y su desarrollo. Estas fitohormonas retrasan la senescencia, influyen en la formación de tallo, aumentan la capacidad de atraer recursos a los tejidos vegetales y promueven proliferación al participar en el control de las transiciones G1/S y G2/M. Se ha observado que la presencia de citocininas incrementa la expresión de una CYCD3 en Arabidopsis,regulador clave de la transición G1/S. Adicionalmente, se ha sugerido que la expresión de ciclinas tipo B o mitóticas también puede ser regulada por la acción de esta fitohormona.
Uno de los principales puntos de control de las citocininas en el ciclo celular es, probablemente, la estimulación de la de-fosforilación de la tirosina 15 y la subsecuente activación de la CDK. Además, durante la formación de la hoja, éstas son necesarias para la celularización y desarrollo adecuado del tejido.
Las fitohormonas pueden presentar interacciones sinérgicas para generar señales que controlan la expresión gènica y modulan, post-traduccionalmente, a sus proteínas blanco. Por ejemplo, las señales generadas por auxinas y citocininas interaccionan para controlar la expresión de una CDKA y su subunidad reguladora, la CYCD3, en tallos de tabaco.
El ABA es otra hormona de particular importancia para el ciclo celular. Es considerada como una hormona que inhibe el crecimiento, ya que afecta a algunas enzimas especificas durante este proceso. En la mayoría de los casos, la respuesta a ABA es lenta y requiere cambios en la expresión génica. En diferentes tejidos vegetales se ha descrito que ABA es un inhibidor de ciclo celular y de la síntesis de ADN, y también se ha demostrado que su presencia induce la expresión del gen que codifica para una proteína inhibidora, KRP1, la cual se une e inhibe la actividad del complejo CYCD/CDKA. En consecuencia, las células se detienen en la transición G1/S.
Los azúcares son la fuente de carbono más importante para la planta, indispensables para la división celular. Las células de tejidos meristemáticos importan hexosas, mientras que los tejidos diferenciados prefieren la sacarosa. Debido a que la sacarosa es la molécula principal de transporte de carbono en plantas, los meristemos requieren invertasas extracelulares que hidrolicen al disacárido. Los azúcares presentan un efecto regulador sobre el ciclo celular, sin embargo, no es claro si dicho efecto se debe a una simple disponibilidad de energía y esqueletos de carbono, o si la concentración del azúcar per se es traducida como una señal. Por ejemplo, se ha observado una correlación positiva entre los niveles de expresión de varias ciclinas (CYCD2;1, D3;2, A3;2 y B2;1) y los niveles de monosacáridos endógenos en células en suspensión de tabaco. En dichas células la duración de la fase S y G2 puede ser modificada al variar los niveles endógenos de monosacáridos .
La interacción de las señales orquestadas por los azúcares y algunas fitohormonas se ha demostrado en Arabidopsis y tabaco. Por ejemplo, las auxinas inducen la sobreexpresión de ciclinas tipo D, pero esta expresión dependiente de auxinas es afectada de manera diferencial si también se encuentran presentes azúcares o citocininas.
Finalmente, se ha reportado que algunas proteínas importantes para el ciclo celular (RBR y E2F) son degradadas vía proteasoma 26S en Arabidopsis cuando la planta es sometida a deficiencia de sacarosa, provocando que se detenga el ciclo celular en la fase G2.
PERSPECTIVAS
En los últimos años se han hecho contribuciones importantes para entender los mecanismos de regulación del ciclo celular y su relación con el desarrollo de las plantas. Se sabe, por ejemplo, que no basta solamente la presencia de cierta ciclina para desencadenar eventos dentro del ciclo celular, sino que, también son importantes las asociaciones que en ciertos momentos ésta pueda establecer con otras proteínas relevantes del ciclo celular. En este sentido, recientemente se han desarrollado estrategias para revelar los mapas de interactomas, particularmente en Arabidopsis. Sin embargo, se requiere de nuevas investigaciones para entender con más profundidad el control del ciclo celular a través de las modificaciones post-traduccionales de las proteínas reguladoras del ciclo celular, así como de la fina regulación por su localización subcelular, expresión génica, síntesis de novo y degradación.
FUENTE:AVANCES RECIENTES EN EL ESTUDIO DEL CICLO CELULAR EN PLANTAS
Temas relacionados:
periódico digital
revista digital
periódico gratis
crear periodico digital
publicaciones digitales
contenidos digitales
También te puede interesar
Esta web se reserva el derecho de suprimir, por cualquier razón y sin previo aviso, cualquier contenido generado en los espacios de participación en caso de que los mensajes incluyan insultos, mensajes racistas, sexistas... Tampoco se permitirán los ataques personales ni los comentarios que insistan en boicotear la labor informativa de la web, ni todos aquellos mensajes no relacionados con la noticia que se esté comentando. De no respetarse estas mínimas normas de participación este medio se verá obligado a prescindir de este foro, lamentándolo sinceramente por todos cuantos intervienen y hacen en todo momento un uso absolutamente cívico y respetuoso de la libertad de expresión.
No hay opiniones. Sé el primero en escribir.
https://www.tribunacontactcenter.com/